pH(ペーハー)
pH(ペーハー)とは、水素イオン濃度のことで、酸性やアルカリ性にどれだけ傾いているかを表します。
pH7.0が中性でこれより低いほうが酸性、高い方がアルカリ性となります。

この酸性、アルカリ性とは、水にどれだけの水素イオンが含まれているかという割合、つまり水素イオン濃度で決まります。知ってのとうり、水はH2Oとして表され、非常に安定した状態で存在するのですが、ごく一部に水素イオン:H+と水酸イオン:OH-という形で存在しています。水素イオンが多いと酸性になり、水酸イオンが多いとアルカリ性になります。
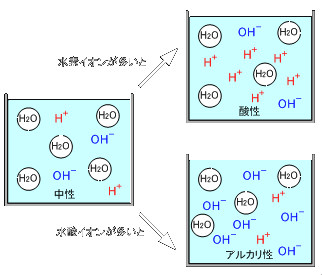
ちなみに水と水素イオン、水酸イオンは
H2O ⇔ H+ + OH-
という関係になります。
この水素イオン濃度:[H+]と水酸イオン濃度:[OH-]には、一定温度の条件下で水素イオン濃度:[H+]と水酸イオン濃度:[OH-]の積が常に一定となる次のような関係があります。
[H+]×[OH-] = 10-14(=一定) ← これを水のイオン積といいます。
この関係を表したのが、次の表です。
| pH | 水素イオン濃度:[H+] | 水酸イオン濃度:[OH-] |
|---|---|---|
| 0 | 1 (1 ) | 10-14 ( 0.00000000000001 ) |
| 1 | 10-1 ( 0.1 ) | 10-13 ( 0.0000000000001 ) |
| 2 | 10-2 ( 0.01 ) | 10-12 ( 0.000000000001 ) |
| 3 | 10-3 ( 0.001 ) | 10-11 ( 0.00000000001 ) |
| 4 | 10-4 ( 0.0001 ) | 10-10 ( 0.0000000001 ) |
| 5 | 10-5 ( 0.00001 ) | 10-9 ( 0.000000001 ) |
| 6 | 10-6 ( 0.000001 ) | 10-8 ( 0.00000001 ) |
| 7 | 10-7 ( 0.0000001 ) | 10-7 ( 0.0000001 ) |
| 8 | 10-8 ( 0.00000001 ) | 10-6 ( 0.000001 ) |
| 9 | 10-9 ( 0.000000001 ) | 10-5 ( 0.00001 ) |
| 10 | 10-10 ( 0.0000000001 ) | 10-4 ( 0.0001 ) |
| 11 | 10-11 ( 0.00000000001 ) | 10-3 ( 0.001 ) |
| 12 | 10-12 ( 0.000000000001 ) | 10-2 ( 0.01 ) |
| 13 | 10-13 ( 0.0000000000001 ) | 10-1 ( 0.1 ) |
| 14 | 10-14 ( 0.00000000000001 ) | 1 (1 ) |
表からもわかるとうり、[H+]×[OH-]が一定であることから、水素イオン濃度が上昇すれば水酸イオン濃度が減少し(酸性化)、水素イオン濃度が減少すれば、水酸イオン濃度が上昇し(アルカリ性化)ます。水素イオン濃度と水酸イオン濃度がバランスしたところがいわゆる中性(酸性でも、アルカリ性でもない所)でpH=7がその位置になります。
[H+] = [OH-] ← 中性
このことから、どちらか一方がわかれば他方の値もわかるので、実際には水素イオン:H+のみを測定して、pHの目安としています。ただ、水素イオン濃度を表すのに0.0000001(10-7)や0.00000001(10-8)では取り扱いが面倒くさいので、デンマークのゼーレンセンが、水素イオン濃度の逆数を常用対数で示したものをpHと定することを提案したわけです。ちょっとややこしいかもしれませんが
pH = -log10[H+]
となります。このことを考えて表をみてみると、水素イオン濃度:[H+] の指数部の絶対値がpHの値になっていることがわかると思います。
ちなみに、pHのpは数学の「べき乗(Power)」の意味で、H は水素イオンのことなので、まさに「読んで字の如く」ということになります。